大阪医科薬科大学
研究のポイント
- 本研究は、オートファジー分泌の抑制がオートファジー‐リソソーム分解系に及ぼす影響をパーキンソン病の病態に関与するα-シヌクレインを指標に調べた。
- オートファジー分泌の抑制により、代償的にオートファジー分解が上昇する一方で、リソソームの形態異常(異常な肥大化と膜ダメージ)と機能低下が誘導された。
- オートファジー分泌の抑制は、α-シヌクレインの細胞外へ分泌を抑制し、界面活性剤不溶性の異常なα-シヌクレインの細胞内蓄積を誘導しており、α-シヌクレインの細胞外分泌について新しい視点を提示した。
研究の概要
パーキンソン病*の発症と進行には、神経細胞内におけるα-シヌクレイン*と呼ばれるタンパク質の異常凝集と、凝集物の細胞間伝播が関与しています。α-シヌクレイン細胞外伝播の分子メカニズムの解明は、パーキンソン病の進行抑制療法の鍵と考えられます。大阪医科薬科大学(高槻市 学長:佐野浩一)医学部内科学 IV 教室 脳神経内科の澤井大樹特任助教と荒若繁樹教授らの研究グループは、細胞間伝播を構成するα-シヌクレインの細胞外分泌に着目し、培養細胞(SH-SY5Y 細胞)において細胞外分泌を担うオートファジー*経路の役割を解析しました。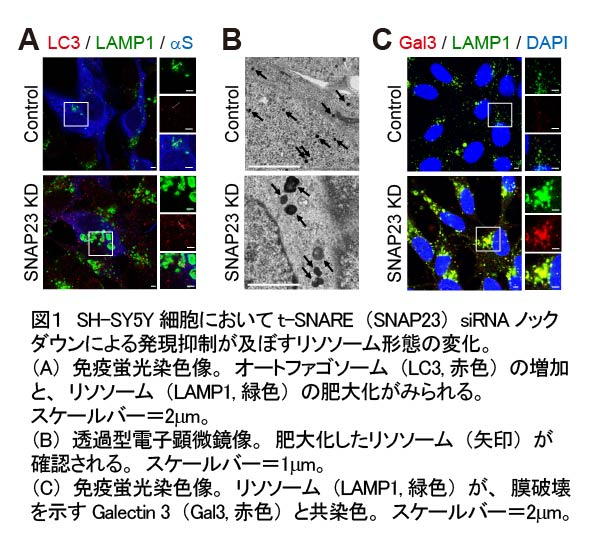 その結果、オートファジー分泌に必須の過程であるオートファゴソームと細胞膜の融合に関与するt-SNARE分子(SNAP 23とSyntaxin 4)及びRAB8A分子の発現をノックダウンすると、LC3-IIで示されるオートファゴソームの形成は促進され、分解基質であるp62の発現減少によって示されるオートファジー分解能の亢進が観察されました。
その結果、オートファジー分泌に必須の過程であるオートファゴソームと細胞膜の融合に関与するt-SNARE分子(SNAP 23とSyntaxin 4)及びRAB8A分子の発現をノックダウンすると、LC3-IIで示されるオートファゴソームの形成は促進され、分解基質であるp62の発現減少によって示されるオートファジー分解能の亢進が観察されました。オートファジー分泌の抑制はその分解を代償的に亢進させる一方で、オートファジー経路に分解酵素を提供するリソソーム*の肥大化・膜破壊と機能低下を引き起こしていました(図1)。
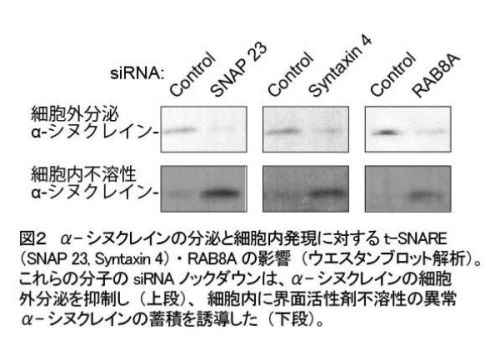
さらに、細胞外へのα-シヌクレインの分泌抑制と、界面活性剤に不溶性のα-シヌクレイン異常体の細胞内蓄積を誘導していました(図2)。
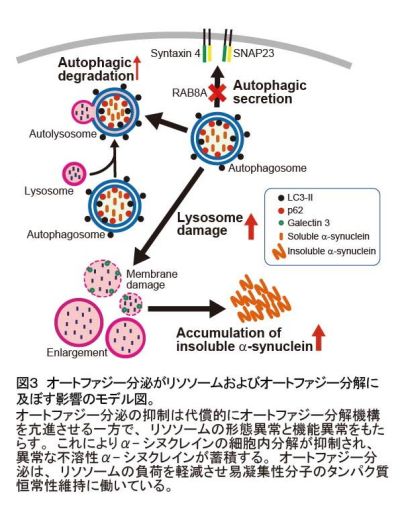
これらの結果は、オートファジー分泌は、オートファジー分解と協調的に細胞内の不要タンパク質の除去に働き、凝集しやすいタンパク質を細胞外に放出することによってリソソームの負担を軽減させることを示していました(図3)。
オートファジー分泌がタンパク質恒常性の維持に果たす役割を初めて示す結果であり、新たなパーキンソン病治療法開発の基盤になると考えられます。
研究の背景
パーキンソン病で起きている異常を根本的に抑える方法を探す試みが活発に行われています。代表的なものとして抗αシヌクレイン抗体療法が挙げられます。この抗体は細胞間に放出されたα-シヌクレインを捕捉し、α-シヌクレインの細胞間伝播を抑制しようとするものです。抗体療法の効果を補助する手段として、α-シヌクレイン細胞外分泌を抑制または促進する方法が考えられます。α-シヌクレインは、小胞体・ゴルジ装置を経由する通常経路と異なる方法[“Unconventional rotein secretion (UPS)”と呼ばれます]で細胞外に分泌され、その経路としてオートファジーの関与が明らかにされています。
オートファジー(自食作用)は、飢餓状態時にタンパク質を分解してアミノ酸を供給する働きが有名です。
非飢餓状態においても、不要となったタンパク質を分解して細胞内のタンパク質恒常性を維持する細胞生存に必要な働きを担っています。分解系としての働きに加えて、UPS の経路としてタンパク質の分泌に関与していることが明らかになってきました。α-シヌクレインの細胞外放出をコントロールする上で、オートファジー分泌は重要なターゲットです。しかし、オートファジーを分解と分泌に振り分ける分子メカニズムは十分に解明されておらず、分泌が分解系との関係を通じてどのようにタンパク質恒常性の維持に寄与しているのか不明でした。
本研究は、オートファジー分泌は分解系と代償的な相互関係を有する一方で、オートファジー分解系に分解酵素を提供するリソソームに形態的・機能的な異常を引き起こし、α-シヌクレインのタンパク質恒常性に影響を及ぼすことを明らかにしました。
社会的影響
本研究は、α-シヌクレインの細胞間伝播を抑制する方法としての細胞外分泌調節の可能性について、オートファジー分泌が担っている働きをオートファジー‐リソソーム分解系との相互関係の点から解析した初めての結果です。α-シヌクレインの細胞間分泌を低下させるためには、オートファジー分泌自体の抑制ではなく、凝集のシーズとなるα-シヌクレインを基質として選択的に認識する分子機序を標的とすることが有効と考えられます。また、オートファジー分泌の促進は、タンパク質恒常性維持の点から影響が少ないことを示唆しています。パーキンソン病の新たな治療標的としてのα-シヌクレインの細胞外分泌について新しい視点を提示するものと考えられます。
用語説明
パーキンソン病
黒質線条体ドパミン神経細胞の変性により脳内ドパミン量が減少し、動作緩慢・静止時振戦といった運動症状が引き起こされる疾患です。ドパミン神経細胞以外の神経細胞も変性することが知られ、嗅覚障害・便秘・幻視・認知症などの多彩な非運動症状が現れます。経口薬によるドパミン補充療法や脳深部刺激療法が行われていますが、症状の進行を抑える治療法は確立されていません。
α-シヌクレイン
パーキンソン病における神経細胞の変性に中心的な働きをしている分子と考えられています。異常に折りたたまれたα-シヌクレインが神経細胞内に蓄積することで神経細胞にダメージを与え、この異常体が細胞間を伝播することによって神経細胞のダメージが脳内に拡がると考えられています。
オートファジー
飢餓状態にさらされたとき、細胞はオートファジーを誘導させて、タンパク質の分解を促し、栄養素であるアミノ酸を供給させます。また、オートファジーは不要となった細胞小器官やタンパク質を分解し、細胞の恒常性維持に働いています。分解機能のほかに、ある種のタンパク質の細胞外分泌に働くことがわかってきました。オートファジー分泌は、多数の分子がカスケード状に働くことで調節されています。本研究で登場するt-SNARE(SNAP 23、Syntaxin 4)およびRab8Aといった分子が、オートファジー分泌に関与することが知られています。
リソソーム
細胞内小器官の一つで、内部に多数のタンパク質分解酵素を含有します。オートファジー分解系は、リソソームから分解酵素の供与を受けて不要となったタンパク質や細胞内小器官を分解します。
研究者のコメント
パーキンソン病の根本的治療として、1)核酸医薬品によるα‐シヌクレインの発現抑制、2)抗体によるα-シヌクレインの細胞間伝播抑制、3)化合物によるα‐シヌクレインの凝集抑制といった方法が開発されています。このほか、α-シヌクレインの分解刺激、細胞内への取り込み調節、細胞外への分泌調節が挙げられます。しかし、これらを標的とした治療法を考えるための細胞内メカニズムが十分に解明されていません。有効な治療法の確立には、多面的なアプローチから効果的な方法を取捨選択する必要があります。本研究では、α-シヌクレインのオートファジー分泌とオートファジー‐リソソーム分解系との相互作用を明らかにしました。
今後、α-シヌクレインのオートファジー分泌を調節する分子、分泌と分解系を振り分ける分子機構を明らかにして、パーキンソン病の治療法の開発に貢献したいと考えます。
特記事項
本研究内容は、米国生化学・分子生物学会が発行しているJournal of Biological Chemistryにおいて掲載されました。論文タイトル:Secretory autophagy mediates lysosomal and autophagic degradation for α-synuclein proteostasis
著者:Taiki Sawai, Yoshitsugu Nakamura, Shigeki Arawaka
澤井大樹(大阪医科薬科大学 医学部 内科学Ⅳ教室 脳神経内科 特任助教)、中村善胤(大阪医科薬科大学 医学部 内科学Ⅳ教室 脳神経内科 助教)、荒若繁樹(大阪医科薬科大学 医学部 内科学Ⅳ教室 脳神経内科 教授)
発表雑誌:Journal of Biological Chemistry
本件に関するお問い合わせ
大阪医科薬科大学 総務部 企画・広報課
Email:hojin-koho@ompu.ac.jp
