国立大学法人筑波大学
学校法人大阪医科薬科大学
学校法人関西医科大学
家族性大動脈解離の症例において同定された新規遺伝子変異を導入した自然発症型大動脈解離マウスモデルを確立し、これを用いて、大動脈解離が発症するメカニズムを調べました。その結果、血管内皮細胞の異常とマクロファージ(免疫細胞)の集積が大動脈解離の発症を促進することを見いだしました。
大動脈解離は、大動脈の壁が突然裂けて血管が破綻するため、速やかな治療が必要となる重大な疾患です。特にマルファン症候群などの遺伝性結合組織疾患を持つ患者では、比較的若年で発症しやすく、予防や治療法の確立が求められています。しかし、発症の分子メカニズムは、いまだ十分に解明されていません。
本研究では、遺伝的要因が関与する家族性大動脈解離患者から同定されたフィブリリン1(FBN1)遺伝子の新規ミスセンス変異(塩基配列の変化により異常なタンパク質が作られる)をマウスに導入し、大動脈解離を自然発症するマウスモデルを確立しました。このマウスでは、上行大動脈において血管壁の内膜中膜亀裂が生じ、炎症細胞の著しい浸潤(集積)とともに解離が進行し、致死的な破裂に至ります。また、組織学的解析と遺伝子発現解析により、血管内皮細胞の異常が解離発症前から認められ、これにより、内膜における単球(白血球)とマクロファージ(免疫細胞)の集積および浸潤が起こり、炎症型・抗炎症型の両方の性質を持つマクロファージが増加することが分かりました。加えて、このミスセンス変異によりフィブリリン1と血管恒常性維持を担うTGFβ結合タンパク質との結合能が失われ、TGFβシグナルが低下することを見いだしました。
以上より、血管内皮細胞とマクロファージの相互作用、およびTGFβシグナルの低下が大動脈解離発症の重要な分子基盤となることが示唆されました。本マウスモデルは、大動脈解離の分子機構の解明と新たな治療法開発に貢献すると期待されます。
研究代表者

筑波大学生存ダイナミクス研究センター
木村 健一 助教
柳沢 裕美 教授
大阪医科薬科大学医学部外科学講座胸部外科学
神吉 佐智子 講師
関西医科大学医学部薬理学講座
中邨 智之 教授
研究の背景
大動脈解離は、大動脈注1)の内膜が裂けてその外側の中膜の中に血液が入りこんで長軸方向(大動脈の血流の流れに沿った方向)に大動脈が裂ける疾患で、短時間で大動脈破裂や心不全に進行し、高い致死率を示します。胸部大動脈瘤が原因となって発症することもありますが、動脈径が正常に近くても発症する例があり、マルファン症候群などの遺伝性結合組織疾患患者においては、若年死亡の主な原因となっています。大動脈解離については、手術検体を用いた病理学的解析がこれまでの主な研究手法でしたが、解離の時間的・空間的進行過程や、血管壁を構成する各細胞の相互作用は十分に解明されていません。一方、さまざまな大動脈解離モデル動物を用いた研究もありますが、いずれも病態進行のメカニズムは不明でした。そこで、本研究では、遺伝的要因が関与する家族性大動脈解離患者において同定された新規遺伝子変異を導入した新たなマウスモデルを確立し、これを用いて解離進行過程における病態メカニズムの解明を目指しました。
研究内容と成果
本研究では、家族性大動脈解離患者で同定された新規のフィブリリン1(FBN1)遺伝子ミスセンス変異注2)をマウスに導入し、大動脈解離マウスモデルを作製しました。細胞外マトリクス注3)の一つであるタンパク質フィブリリン1注4)は、細胞外に放出されるとミクロフィブリルと呼ばれる線維状の構造をとり、血管壁の弾力を保つのに重要な弾性線維(弾性板)の形成や、血管恒常性維持に関与するタンパク質TGFβなどの成長因子の調節に寄与しています。今回作製した大動脈解離マウスモデルの大動脈壁におけるフィブリリン1の発現を免疫組織染色によって確認したところ、中膜において発現の著しい低下が認められ、弾性板が脆弱化して複数の断裂が生じていました。そして、生後3週間から大動脈解離を発症し、5週齢までに約50%のマウスが死亡しました。解離を発症したマウスは、血管壁に複数の内膜中膜亀裂を伴い、血流の流れる方向に沿って亀裂部位が進展している様子が観察されました。また、解離が進行するとともに多数の免疫細胞が血管内膜に浸潤(集積)していることが分かりました。そのため、血管内膜を構成する血管内皮細胞を詳しく調べてみると、解離の発症前から血流に対する配向性が失われるメカノセンシング注5)異常を示し、免疫細胞の内膜への接着に重要な働きを示す分子VCAM-1およびICAM-1が上昇していることが分かりました。次に、血管壁へ浸潤している免疫細胞を調べるために、シングルセルRNAシーケンシング解析注6)による遺伝子発現解析と免疫組織染色を行いました。すると、解離発症前から血管内膜に局在する単球(白血球)とマクロファージ(免疫細胞)の存在が認められ、解離進行に伴い炎症型・抗炎症型の両方の性質を持つCCR2陽性マクロファージ集団が特異的に増加することが明らかとなりました。一方で、今回同定したFBN1遺伝子の変異部位は、TGFβを細胞外マトリクスに蓄える作用をもつタンパク質LTBPs注7)と結合するドメインに位置しています。そのため、変異タンパク質の生化学的性質および大動脈壁の恒常性への影響を評価しました。その結果、フィブリリン1変異タンパク質を発現した細胞では、細胞外へのフィブリリン1の分泌が著しく低下し、LTBPsとの結合も大きく障害されていることが分かりました。さらに、これまで報告されていた他の大動脈瘤マウスモデルとは異なり、大動脈組織でのシグナル伝達タンパク質pSmad2やpERK1/2レベルは低下し、TGFβシグナルが抑制されていることを見出しました。
以上の結果から、血管内皮細胞とマクロファージの相互作用、およびTGFβシグナルの抑制が大動脈解離発症の重要な分子基盤であることが解明されました(参考図)。
今後の展開
本研究で確立した新規大動脈解離マウスモデルにより、大動脈解離の発症初期における炎症機構、特に血管内皮細胞とマクロファージの相互作用が明らかになりました。今後はこのモデルを活用し、内膜中膜亀裂に関与する新たな標的分子の同定を進め、家族性および孤発性大動脈瘤・解離の病態理解を深めるとともに、マクロファージを標的とする新たな大動脈解離治療法の開発を目指します。
参考図
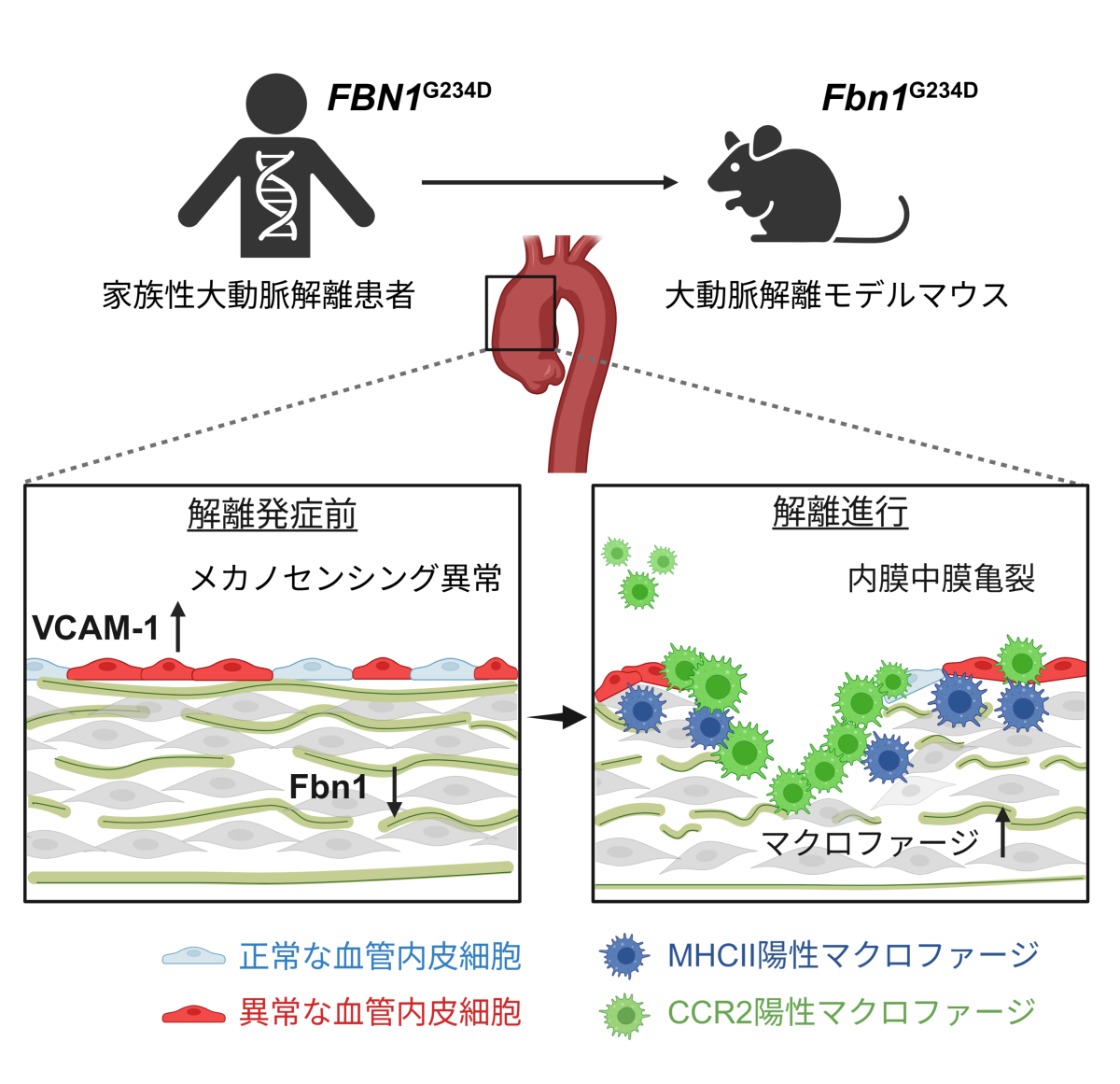
図 本研究の概要図
ヒト大動脈解離患者から同定したFBN1遺伝子変異(FBN1G234D:フィブリリン1タンパク質の234番目のグリシン(G)がアスパラギン酸(D)に変わる変異)をマウスに導入し大動脈解離マウスモデルを作製した。このマウスでは、血管壁におけるフィブリリン1タンパク質(Fbn1)の発現低下(↓)が認められ、解離発症前から血管内皮細胞のメカノセンシング異常や免疫細胞の内膜への接着に重要な働きを示す分子VCAM-1発現亢進(↑)が見られた(図左下)。解離進行に伴って、内膜中膜亀裂が広がり、内膜直下にはMHCII(抗原を提示する分子、MHCクラスII)陽性マクロファージや炎症型・抗炎症型の両方の性質を持つCCR2陽性マクロファージが集積・浸潤し、病態を悪化させることが分かった(図右下)。
用語解説
注1) 大動脈
内膜、中膜、外膜の3層構造で構成されている。内膜は最も内側の血液と接する層で、血管内皮細胞から成る。中膜は弾性線維と平滑筋細胞を含み、血管の収縮・拡張を調節し、特に大動脈では弾性線維が発達している。外膜には線維芽細胞や結合組織があり、血管を支持する役割を担う。
注2) ミスセンス変異
遺伝子のDNA配列のうち、1塩基対が他の塩基対に置換することで、アミノ酸配列の一部が変化する変異。
注3) 細胞外マトリクス
細胞外に局在する高分子複合体の総称で、組織や細胞の機能制御に必須の役割を果たす。皮膚などで作用することが知られているエラスチンやプロテオグリカンなど、多様な分子から構成される。
注4) フィブリリン1
細胞外マトリクスの一つ。マルファン症候群などの結合組織疾患の原因遺伝子の一つとしても知られている。細胞外に分泌されると、ミクロフィブリルという線維状構造をとり、弾性線維形成やTGFβなどの成長因子の調節に寄与している。
注5) メカノセンシング
細胞が外界の機械的な刺激(力、圧、流体など)を感知し、その情報を細胞内に伝え生化学的なシグナルに変換するための一連の機構のこと。
注6) シングルセルRNAシーケンシング解析
次世代シーケンサーを用いて、個々の細胞が保持しているmRNA全体を質的、量的に網羅的に調べる方法。(脳科学辞典より引用)
注7) LTBPs(Latent TGFβ binding proteins)
LTBPファミリーに属する分泌タンパク質で、細胞外マトリクスの成分。
研究資金
本研究は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業(課題名:新規大動脈解離マウスモデルを用いたマルファン症候群等類縁疾患の大動脈解離発症機序の解明)、循環器疾患・糖尿病等生活習慣病対策実用化研究事業(課題名:メカノセンシング機構の破綻による大動脈疾患の病態解明とバイオマーカー診断法の開発)、日本学術振興会科学研究費助成事業(JP23H00431、JP21KK0151)、先進医薬研究振興財団、かなえ医薬振興財団、The Everest Grant from The Marfan Foundation等の支援を受け、大阪医科薬科大学、関西医科大学、Ghent University(ベルギー)、Ghent University Hospital(ベルギー)、Oregon Health & Science University(アメリカ)との国際共同研究として行われました。
掲載論文
【題 名】
Novel aortic dissection model links endothelial dysfunction and immune infiltration.
(血管内皮細胞異常と免疫細胞浸潤による新たな大動脈解離病態機構の解明)
【著者名】
Kenichi Kimura1, Eri Motoyama1, Sachiko Kanki2, Keiichi Asano1, Patrick Sips3, Md Al Amin Sheikh1,4, Maria Thea Rane Dela Cruz Clarin1,4,5, Erna Raja1, Mariko Takeda6, Ryutaro Ishii1,7, Kazuya Murata8, Violette Deleeuw3, Laura Muiño Mosquera9, Julie De Backer10, Seiya Mizuno8, Lynn Y Sakai11, Tomoyuki Nakamura6, and Hiromi Yanagisawa1, 7.
1: Life Science Center for Survival Dynamics, TARA, University of Tsukuba, Tsukuba, Japan
2: Thoracic and Cardiovascular Surgery, Osaka Medical and Pharmaceutical University, Osaka, Japan
3: Department of Biomolecular Medicine, Ghent University, Ghent, Belgium
4: School of Integrative and Global Major, University of Tsukuba, Japan
5: National Institute for Material Science, Japan
6: Department of Pharmacology, Kansai Medical University, Osaka, Japan
7: Faculty of Medicine, University of Tsukuba, Tsukuba, Japan
8: Laboratory Animal Resource Center, Transborder Medical Research Center, Institute of Medicine, University of Tsukuba, Japan
9: Department of Pediatric Cardiology and Center for Medical Genetics, Ghent University Hospital, Ghent, Belgium
10: Department of Cardiology and Center for Medical Genetics, Ghent University Hospital, Ghent, Belgium
11: Department of Molecular & Medical Genetics, Oregon Health & Science University, Oregon, USA
【掲載誌】
Circulation Research
【掲載日】
2025年5月14日
【DOI】
10.1161/CIRCRESAHA.125.326230
本件に関するお問い合わせ
【研究に関すること】
柳沢 裕美(やなぎさわ ひろみ)
筑波大学生存ダイナミクス研究センター 教授
TEL: 029-853-7318
Email: hkyanagisawa@tara.tsukuba.ac.jp
URL: http://saggymousehkytsukuba.com/
【取材・報道に関すること】
筑波大学広報局
TEL: 029-853-2040
E-mail: kohositu@un.tsukuba.ac.jp
大阪医科薬科大学 総務部 企画・広報課
TEL: 072-684-6817
E-mail: hojin-koho@ompu.ac.jp
関西医科大学広報戦略室
TEL: 072-804-2128
E-mail: kmuinfo@hirakata.kmu.ac.jp
